你知道吗?
像抗体、疫苗、蛋白质这些重要的生物制品,想要它们在冻融后乖乖发挥威力,可要好好守护其结构和生物活性才行!倘若稍不留神操作不当,则可能导致微生物污染、生物分子变性、冻融效率低等问题。
对比冷库/超低温冰箱冷冻,水浴/室温复融等传统冻融方式,冻融机的出现可让冻融质量提升的不止一星半点儿~如今已成为生物制药原液冻存融场景中必不可少的设备。
近日,国家药监局审核查验中心发布了《工艺验证检查指南(征求意见稿)》,要求冻融过程速率等参数全流程监管,并在安全性、一致性、稳定性等方面提出了新的要求,持续加强药品工艺验证的质量管理。
由乐纯生物与海尔生物医疗经过数年联合开发的可控冻融系统凭借着温度可控可追溯、冻融高效高质量等优势,能为从事抗体原料药、疫苗原料药以及重组蛋白等液态生物制品的生物制药公司,及承接CDMO业务的药企提供专业的冻存融场景解决方案,满足了新法规的要求。
《工艺验证检查指南》要求
每批原液应按规定的工艺生产、单独检验,并符合相应质量标准要求,与此同时,混合的各批原液要实现可追溯。

海尔生物医疗可控冻融系统
过程可溯 提升冻融工艺研究效率
海尔生物医疗冻融机可实现冻融全程程序控制,实现全过程追溯,温度曲线实时记录,并支持FDA 21 CFR part11 审计追踪要求,符合 GMP 要求,具有完整的 GAMP5 验证体系,安全合规。
《工艺验证检查指南》要求
当存在多批原液混合生产一批制剂时,工艺验证应重点关注验证批次批量的代表性、解冻和混合过程的参数控制、配制后的均匀性等方面。
工艺验证批次的生产规模应具有代表性,关注生产最大产量的限定,保证生产出具有批间一致性、质量可控的产品。

海尔生物医疗可控冻融系统
冻融工艺一致 制品品质稳定
海尔生物医疗冻融机可实现原液冻融过程参数控制、选配混匀功能实现复融过程制品混匀。原液不同批次使用相同冻融工艺可实现过程复现,保障批间一致性,原液产品质量可控。
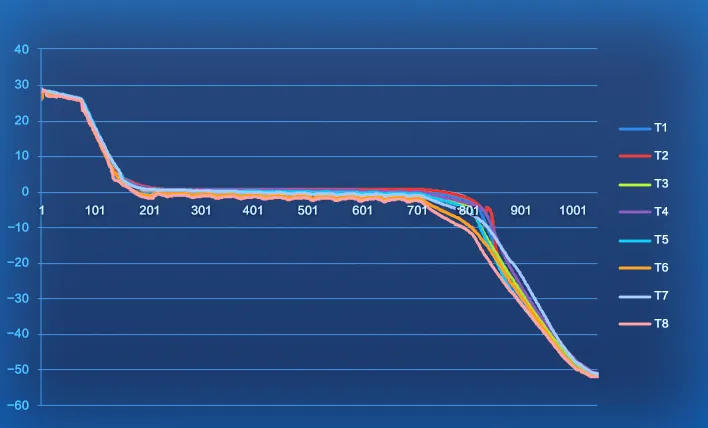
《工艺验证检查指南》要求
原液的冻融过程可能对质量产生影响,例如过慢或过快的冻融速率,会影响产品的纯度和活性。
对于冻融过程,可采用程序控温或梯度控温的方法进行控制,并综合考虑装载情况对产品冻融的影响,验证过程应评价冻融产品包装温度分布情况,确认冻融产品每步骤均达到预定温度。

海尔生物医疗可控冻融系统
冻融温度可控 程序按需制定
海尔生物医疗冻融机采用程序控温,实现高效冻/融,全流程温度可控,根据制品特性设定冻融工艺曲线,能精准控温,满足多样性制品的冻/融需求。与此同时,还能实现速冻速融,其特有制冷系统-热传导及热辐射,导温速度更快,保障制品冻融品质。
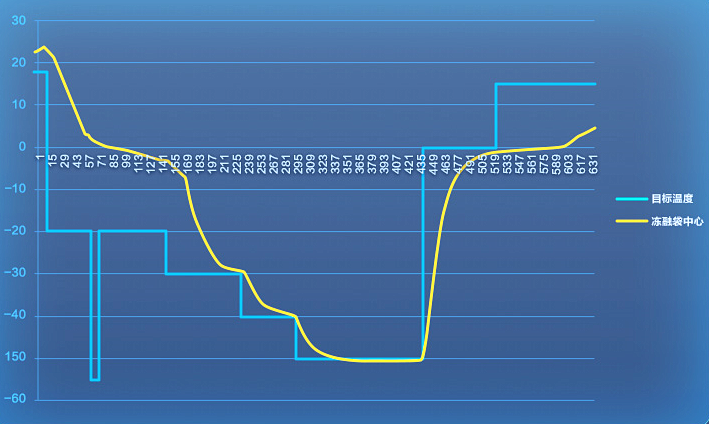
《工艺验证检查指南》要求
明确定义冻融过程的工艺参数,并进行验证。对关键或重要操作参数要进行评估,对是否应在实验室中比例缩小模型进行质量特性的研究,如存在任何关键参数,应在商业化规模下进行监控和验证。
而在工艺验证过程中,应关注冻融相关的参数控制及冻融前后产品质量的变化情况,充分评价冻融过程在批次间是否稳定一致、具有重现性。

海尔生物医疗可控冻融系统
工艺线性放大 研发、生产无缝衔接


如有任何样品申领需求,欢迎扫描如下二维码

后续将为大家带来更多介绍,敬请期待!


 EN
EN