2024年7月16日起,乐纯生物集团携手易享平台开启系列直播课程,从不同应用场景及痛点带来我们的思考和方案。今天就为带大家带来由乐纯生物集团验证中心技术总监王红女士带来的回顾分享。

王红
乐纯生物集团验证中心技术总监及
CNAS实验室授权技术负责人、实验室主任
拥有12余年药物领域相关工作经验。2021年加入乐纯生物集团旗下格氏流体,后担任集团验证部门技术总监以及CNAS实验室授权技术负责人、实验室主任,多次参与客户端无菌检查的咨询与支持、行业团标的起草工作、以及同药监部门的技术交流与培训等,对于一次性系统、过滤器、工艺组件以及消毒剂效力验证等法规、验证有着丰富的经验。
课程主题为《无菌工艺过滤验证及检查问题分享》,如下为当日课程精简文字简要梳理:
各位老师,我是上海乐纯生物集团负责验证的王红,今天很高兴与大家分享关于制药行业过滤器的风险管理和供应验证策略,以及无菌检查过程中的常见问题。
今天的分享将围绕制药行业中使用的过滤器展开。大家知道,过滤器的种类很多,包括气体过滤器和液体过滤器。液体过滤器可以进一步分为预过滤器和除菌过滤器。不同类型的过滤器在不同的应用点上有不同的法规要求和验证关注点,因此需要根据实际情况和风险来制定验证策略。
接下来,我会提及几点关于过滤器的法规要求区别点,对于液体除菌过滤器,使用后必须进行相应的完整性测试,这是国内外法规的明确要求。基于2022年EU GMP的要求,对于液体除菌过滤器的完整性测试有更进一步的要求,例如PUPSIT。对于使用前的完整性要求,国内法规要求基于风险评估来决定是否进行完整性测试,以及测试应在灭菌前还是灭菌后进行。
接下来我想从产品验证的角度来分享第二个视角,尤其是关于过滤器验证的要点。
首先,对于除菌过滤器的验证,它是工艺验证的重要组成部分,这一点大家应该已经非常熟悉了。
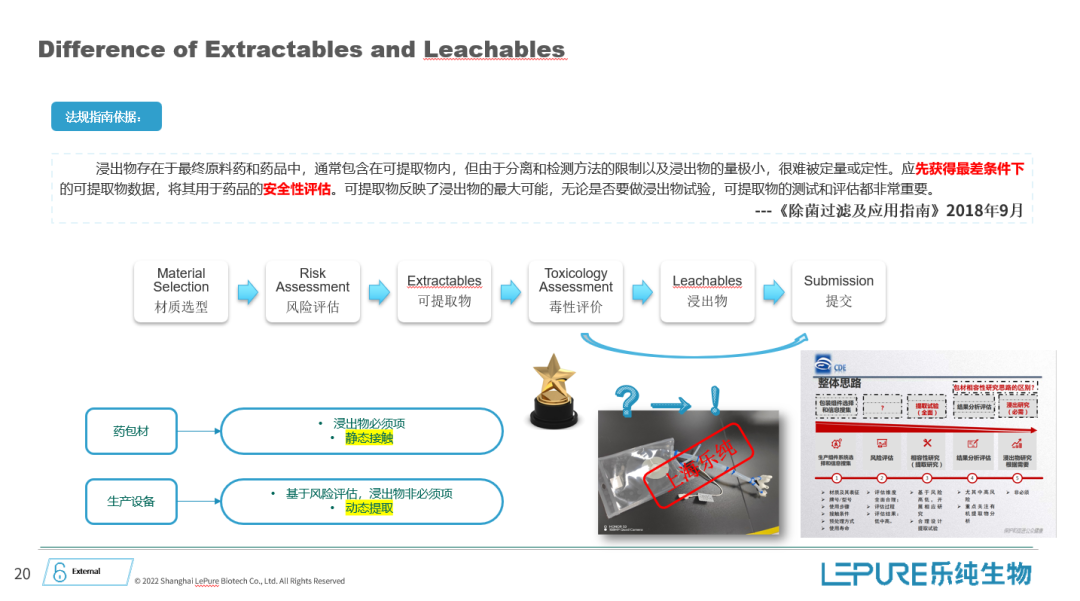
然而,我认为有一个容易被忽视的点,就是关于减菌过滤器的验证。很多时候我们认为减菌过滤器的风险较低,因此忽略了相关的验证要求。但实际上,在2018年发布的《除菌过滤技术及应用指南》中,明确指出减菌过滤器的工艺验证同样是产品工艺链的一部分,这项验证是不可或缺的。并且,指南中也明确说明了工艺验证应包含哪些测试内容。
其次,我想谈谈过滤器的设计和法规要求。根据2010年的GMP规定,在除菌过滤之前,必须对前面的生物负载进行严格控制。此外,基于法规要求,通常建议在安装除菌过滤器时采用冗余设计,也就是在系统中设置两级串联的除菌过滤器。
最后,我想强调与过滤器和工艺产品接触时的相容性问题。任何与工艺产品直接接触的过滤器都可能影响产品的纯度、有效性、安全性或其他质量指标。因此,但凡与产品接触的过滤器,我们均应思考两者之间的相容性,包括药液是否会与过滤器材料发生化学反应以及过滤器是否会释放潜在的迁移物质,进而影响最终产品的质量。此外,还需要考虑过滤器是否会吸附产品中的主要活性成分,这也是验证过程中的一个关键点。
总之,虽然过滤器虽只是制药过程中的一个小环节,但它的合规性和科学验证是确保产品安全性的重要环节。作为过滤器供应商和制药企业,我们都必须高度重视过滤器的合规性,确保它们符合相关法规要求。
接下来,我想详先探讨一下气体除菌过滤器的验证问题。各位老师,气体过滤器在我们的日常工作中并不陌生,几乎每个制药企业都会使用。然而,一个值得我们思考的问题是,大家是否曾为气体过滤器进行过专门的验证?
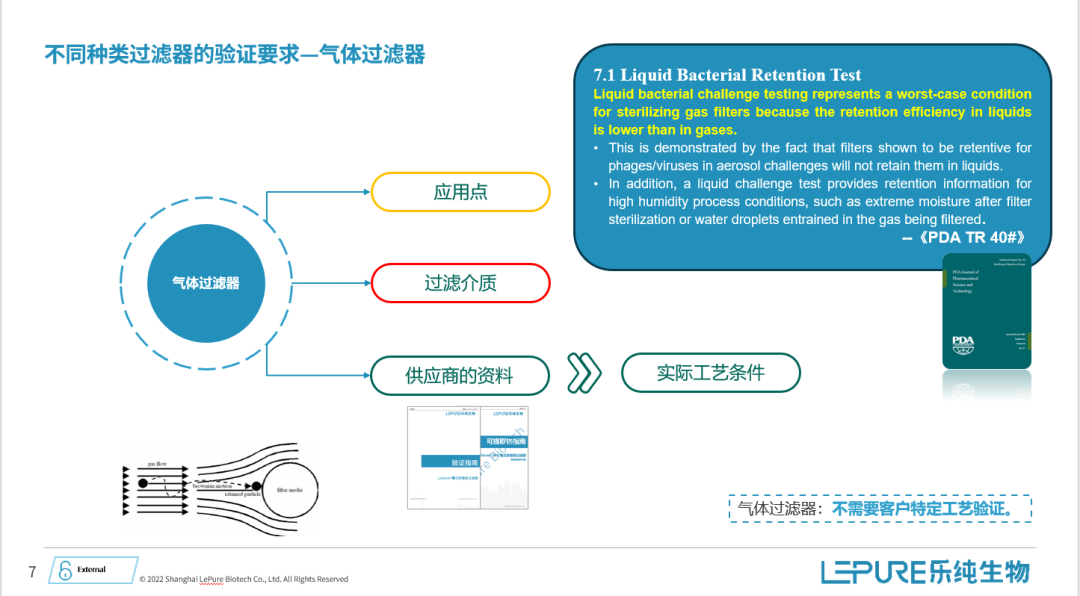
对于不同的应用场景,例如压缩二氧化碳、压缩氮气或压缩空气,是否需要对气体过滤器进行专门的验证呢?
一般情况下可能并没有进行过这种特定的验证。实际上,大多数情况下,供应商提供的资料已经足以涵盖实际应用中的需求,因此不需要额外的验证。
这个观点在PDA第40号关于气体除菌过滤器的指南文件中也得到了支持。指南指出,液体模式截留往往代表着最差的情况,基于实际气体滤器的使用情况,能够更全面地评估过滤器在未来生产过程中的表现。
因此,回到一个问题。
气体过滤器的验证是否必要?大多数情况下是不需要的。但这并不意味着我们可以忽视这个问题。
我们应当对供应商提供的验证文件进行仔细评估,确保其内容能够满足我们的实际需求。通常来说,厂家提供的验证指南和可提取物指南能够回答大部分的验证问题。
最后,我想结合一些检查过程中的实际案例,分享一些经验。
比如,在2022年,四川的一家制药企业被要求提供二氧化碳气体进入无菌药品中的空气过滤器的相关验证资料。类似的,山东和海南的制药企业也分别被要求补充提供氮气除菌过滤的相关研究资料。通过这些案例可以看到,虽然在大多数情况下气体过滤器不需要特定的验证,但检查过程中依然会关注这类问题。
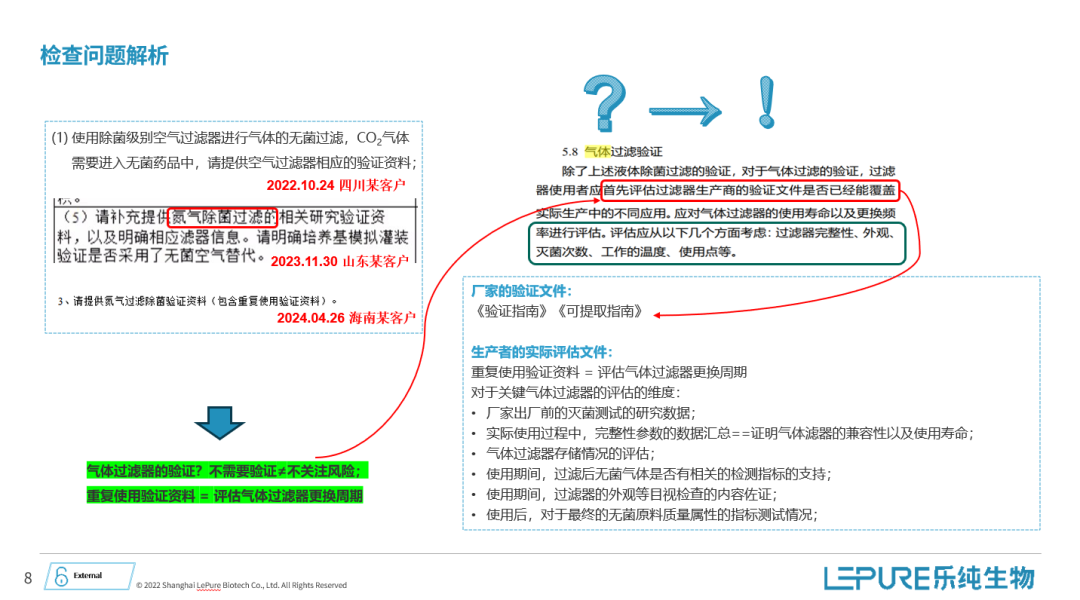
我们应如何应对这些问题呢?首先,尽管不需要特定的验证,我们依然需要关注相关风险。我们应仔细评估供应商提供的验证文件,看其是否能够覆盖我们的实际生产应用需求。通常,供应商提供的验证指南和可提取物指南这两份文件能够很好地回应这类问题。这就是我们在气体过滤器验证及检查过程中所遇到的一些问题的分享。
接下来,我们讨论第三个问题——检测老师指出:关于气体过滤器重复使用的验证材料需要提供。
首先,什么是“重复使用”?
它实际上涉及到气体过滤器的更换周期。通常,气体过滤器不会像一次性使用的过滤器那样在每批次生产后更换。因此,这个问题实质上等同于评估气体过滤器的更换周期。
那我们该如何从不同的维度评估气体过滤器的更换周期呢?在这里,我们需要考虑以下几个因素:
- 过滤器的完整性:这是关键指标之一。完整性测试可以包括外观检查、灭菌次数记录、以及实际生产过程中温度等参数的影响。每家企业的工艺条件和应用点各不相同,因此无法提供一个通用的评估方法,而必须根据具体的使用情况进行特定评估。
- 出厂前的研究数据:供应商在产品出厂前,通常已经进行过耐热性和稳定性的研究,这些数据可以作为评估过滤器更换周期的重要参考。
- 实际使用中的数据汇总:在使用期间,定期评估过滤器的完整性也是必要的。有些企业可能会选择在每次更换前后进行完整性测试,以确保过滤器的有效性。
- 过滤器的存储情况:如果过滤器在使用后有一段存储期,那么存储条件对过滤器性能的影响也需要考虑。
- 无菌气体的检测:对于经过过滤的气体,是否符合无菌要求也是一个评估点。同时,最终无菌原料的质量属性是否受到影响也是评估的重点。
接下来,我们再讨论液体过滤器的验证。与气体过滤器不同,液体过滤器通常需要进行特定的验证,因为不同的应用点、产品和过滤参数会影响过滤器的性能。液体过滤器的验证不仅包括除菌过滤器,还应涵盖预过滤器。
在验证测试中,我们可以关注以下几个方面:
- 微生物研究:对于除菌级过滤器,细菌截留测试是必不可少的。测试前需要进行生存性研究,以确保测试的可靠性。
- 理化研究:这包括过滤器与液体接触时的相容性研究,例如化学兼容性测试、产品湿润完整性、吸附测试、提取物&浸出物,以及安全性评估等。
应对不同应用位点的过滤器,基于风险评估的方式,优化验证组合,在确保产品安全和合规的前提下,提高经济性和科学性。
最后,我们再来说下预过滤器,众所周知预过滤器在过滤系统中起到的核心作用主要是降低微生物负载,而非完全除菌。它的功能更多是为后续的除菌级过滤器减轻负担,延长其使用寿命。因此,在验证过程中,预过滤器的要求和除菌级过滤器的要求有所不同。
关于验证预过滤器,主要满足以下需求:
- 微生物负载的降低:预过滤器的主要目标是减少液体或气体中的微生物含量,而非达到无菌状态。这一任务主要由后续的除菌级过滤器来完成。因此,在验证预过滤器时,并不强制要求进行细菌挑战测试。这个测试主要用于验证除菌级过滤器的有效性。
- 相容性方面:预过滤器需要验证其与工艺产品之间的化学兼容性。这包括对滤芯材料是否能够抵抗化学品的腐蚀,以及是否会释放出任何可能影响产品质量的物质的评估(E&L)。
- 吸附研究:在某些情况下,预过滤器的材质可能会对某些活性成分或其他关键物质产生吸附作用,此方面应该在选型阶段进行关注。
- 验证覆盖范围:当预过滤器和除菌级过滤器的材料、生产厂家等均一致时,可以通过除菌级过滤器的验证来覆盖预过滤器的验证需求。然而,如果两者的材质不同,除菌级过滤器的验证就无法涵盖预过滤器的情况,此时就需要单独为预过滤器进行验证。
那当然,更重点的除菌需求是需要依靠最后的除菌滤器来满足的,所以它要通过这些关键测试来验证的其除菌性:细菌挑战测试:这是验证除菌级过滤器最重要的测试之一,它评估过滤器在工艺条件下是否能够有效拦截规定的微生物。测试中通常会在挑战液体中加入特定的挑战菌,并在工艺条件下进行过滤,观察菌种是否会穿透过滤器。在进行细菌挑战测试之前,必须先进行生存性测试,确保挑战菌在液体环境中能够存活。
实际生产过程中,许多关键工艺参数,如压力、温度、接触时间等,都会影响过滤器的性能。在进行验证时,需要针对每个参数进行具体分析,确保其对关键质量属性的影响被充分评估。例如,压力对细菌截留测试至关重要,而对化学兼容性测试的影响可能较小。因此,基于实际工艺条件的验证测试是确保过滤器性能和产品质量的关键。
最后,对于细菌截留测试、化学兼容性测试、提取浸出等,在检查过程中可能有些相关问题,如下是一些总结和关键点说明:
细菌截留测试
挑战菌种选择的合理性?
使用缺陷短波单胞菌作为挑战菌种是法规指南明确指出的,其具有代表性,因为它是水源性的革兰氏阴性菌,且其尺寸小且易维持单一分散状态,且是目前已知最小菌。在细菌截留测试中,选择合适的菌种很关键,当然企业也可以根据具体生产情况进行评估
0.2μm孔径滤器一定是除菌级过滤器吗?
需要注意的是,细菌截留测试是衡量是否为除菌过滤器的黄金标准,而非孔径来标定过滤器的除菌能力。
化学兼容性测试
化学兼容性能用膜片测试吗?
化学兼容性不仅仅针对过滤膜的核心层,还包括支撑层、内外骨架以及O型圈等。考虑化学兼容性时,要注意整体装置的性能,而不仅仅关注核心膜。
提取物与浸出物测试
无菌检查中的其他问题,可以思考
请提供PP过滤器完整性测试参数?
我们知道,由于PP过滤材料的特性,其无法实现完整性测试,那么对于这个问题,我们应该如何思考以及回应?
请提供批量变大后的验证文件?
验证包括几项验证测试,不同的测试有不同的参数考察,因此,,应基于风险评估来决定是否重新启动验证。
对于过滤消毒剂的过滤器是否有验证资料?
关于该问题,可以查看乐纯生物集团公众号“乐纯生物LePure”文章《消毒剂与过滤器之间适应性评估》。
长按识别下方二维码
完成注册即可观看完整研讨会视频

观看视频
更多推荐
直播回顾:无菌工艺过滤验证及检查问题分享
直播回顾:从小试工艺开发到生产放大的贴壁细胞3D培养解决方案


 EN
EN