前世 • 来源

因具有易于培养、转染效率高等特点,HEK293 细胞迅速成为生物医学研究的宠儿。商业化的 HEK293 细胞均来源于 1977 年 Frank Graham 博士转化的这株细胞。
通过自然进化和人工干预,HEK293 细胞逐渐发展成了4种广泛使用的 HEK293 突变细胞系:HEK293-H、HEK293-F、HEK293-E 和 HEK293-T ,这些细胞具有快速生长、悬浮生长、无血清依赖性、有翻译后的后加工修饰、细胞遗传表型稳定、 GMP 条件下易于放大生产等特点。
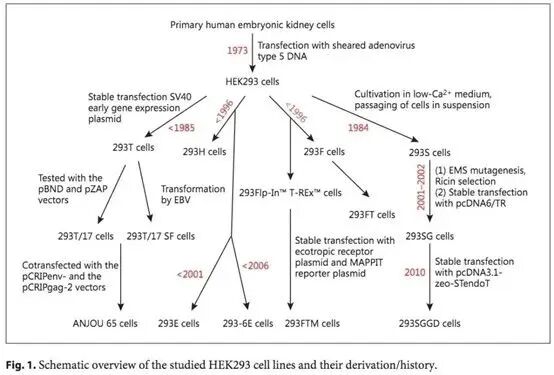
图/来自文献Hu J, et al, Cells Tissues Organs,2018
今生 • 应用
因为 HEK293 细胞系是人类来源的细胞且具有良好的质粒瞬时转染效率和保持外源基因表达的高稳定性,目前广泛应用于生产重组蛋白、病毒样颗粒和病毒载体等领域,成为继 CHO 细胞之后又一个多功能细胞 “工厂”。
随着细胞和基因治疗领域的快速发展,病毒载体生产需求增大, HEK293 细胞在 CGT 领域的应用也日益成熟:
- 免疫细胞疗法中的慢病毒载体生产
- 基因治疗疗法中的腺相关病毒载体生产
- 溶瘤病毒疗法中的腺病毒载体生产
HEK293 细胞系可以用于贴壁培养、微载体培养、无血清悬浮培养等多种培养方式。然而传统的贴壁细胞培养有无法规避的风险和缺点:
- 使用牛血清,有动物来源潜在病毒污染的风险
- 无法进行高密度培养,培养方式较为费时费力
- 难以进行规模化方法生产,生成成本较高
悬浮细胞培养可以生长于无血清培养基,培养基成分明确,简化产物下游工艺,悬浮培养具备安全、便捷、高效的特点,成为当下主流的大规模 HEK293 生产细胞培养方式。

表1. 悬浮培养和贴壁培养对比
在使用 HEK293 细胞生产病毒载体等基因治疗产品时,因为细胞株是重要的生产起始原材料,需要遵守FDA和NMPA的药典和有关指导原则对药品生产用细胞株的法规要求:
细胞株的来源:细胞株作为重要的生产起始原材料,其来源需要清晰可溯源,有明确的知识产权授权和追溯体系,确保产品从生产到使用的每个环节都可以追踪。
细胞库的建立和管理:要求建立主细胞库(MCB)和工作细胞库(WCB),并进行一系列的检测以确保细胞的安全性和稳定性。
安全性评估:细胞株需要进行安全性评估,包括但不限于微生物污染、致瘤性和免疫原性等。
生产过程控制:细胞的生产过程需要在 GMP(良好生产规范)条件下进行,确保生产过程的一致性和可控性。
质量控制:细胞产品需要进行严格的质量控制,包括细胞的活性、纯度和效力等。
因此,根据法规要求,一家 biotech 企业要获得一款生产细胞株需要花费的成本是多方面的,也是高昂的,常常达到千万级别:
- 从外部引进细胞株使用授权
- 细胞株驯化与单克隆筛选
- GMP级别细胞库的建立
- 细胞库的全面表征与检测
- 细胞库的保存与维护
近日,行诚生物作为专业的基因和细胞治疗CDMO为赋能行业,帮助Biotech企业在购买授权和建库的工作中简化流程并节省费用,与 HEK293 细胞株大中华区独家 Sub Liecense 授权服务商康晟生物(QuaCell,乐纯生物旗下细胞培养品牌)合作发布了GMP版本即用型HEK293细胞库产品,帮助Biotech企业应对CLD应用以及未来IND申报中对于细胞系溯源性的法规要求的挑战。

关于乐纯生物
上海乐纯生物技术股份有限公司成立于2011年,以外延式增长路径并入格氏流体、康晟生物、斯坦利思等优秀品牌,业务范围覆盖一次性使用系统、过滤纯化、细胞培养、洁净室污染控制四大系列。十余年来,乐纯生物始终坚持科研导向,致力于为生物制药等行业提供优质、创新的上游耗材及工艺技术服务,是中国领先的生物工艺整体解决方案及服务提供商。
使命愿景:以技术创新为驱动,提供高品质的生物工艺解决方案,致力于成为全球生物制药企业最信赖的合作伙伴。
乐纯生物旗下中山康天晟合生物技术有限公司聚焦于生物制药行业宿主细胞开发研究、细胞培养技术与工程工艺研究、培养基配方开发等方面。公司目前拥有约17000㎡集培养基开发与生产,细胞株开发到GMP中试生产的现代化生物医药创新服务平台,秉承ISO、GMP法规要求,专注于细胞培养基的研究和制造,为全球生物制药与基因和细胞治疗企业提供关键的原材料。
关于行诚生物
行诚生物(CoJourney)是一家集质粒、病毒载体、mRNA生产制备和分析检测为一体的专业细胞和基因治疗CDMO。我们提供质粒、病毒载体和mRNA的制备的工艺开发、cGMP生产、分析方法开发和产品检测放行等定制化服务。公司由细胞和基因治疗领域成绩斐然的科学家和具有商业化产业经验的资深专家共同创立,总部位于中国浙江和美国费城,业务辐射世界各地。同时,行诚生物建立了符合FDA、EU、NMPA法规的质粒和病毒cGMP生产设施,拥有世界领先的研发和生产仪器设备,提供从研发到cGMP级别的不同生产规模的质粒和病毒制备服务。
我们用领先行业标准的稳健工艺确保为您提供高纯度、高产量、高性价比的优质产品,赋能于您,成为您基因和细胞治疗产品开发旅程中值得信赖的合作伙伴!


 EN
EN