在生物制药领域,无菌过滤工艺是确保最终产品质量和安全性的关键环节之一。其中,用于去除细菌和控制生物负荷的除菌过滤系统一直是无菌过滤工艺中的重要环节。
为提高行业的无菌认知和无菌保证水平,由欧盟、PIC/S和WHO共同协作完成的欧盟新版《GMP附录1-无菌药品生产》于2022年8月正式发布,行业内针对新版欧盟GMP附录陆续开展了多次行业研讨会。
本文将基于欧盟GMP附录及相关研讨会内容,深入探讨除菌过滤系统使用前灭菌后完整性测试(PUPSIT)的实施要点及风险考量。
PUPSIT定义
根据EU 新版 GMP 的相关规定“8.87 The integrity of the sterilised filter assembly should be verified by integrity testing before use (pre-use post sterilisation integrity test or PUPSIT), to check for damage and loss of integrity caused by the filter preparation prior to use.”
除菌级过滤器必须在使用前灭菌后执行完整性测试 (即PUPSIT),以检查由于使⽤前过滤器准备(例如:灭菌过程等)造成的损坏和完整性损失。
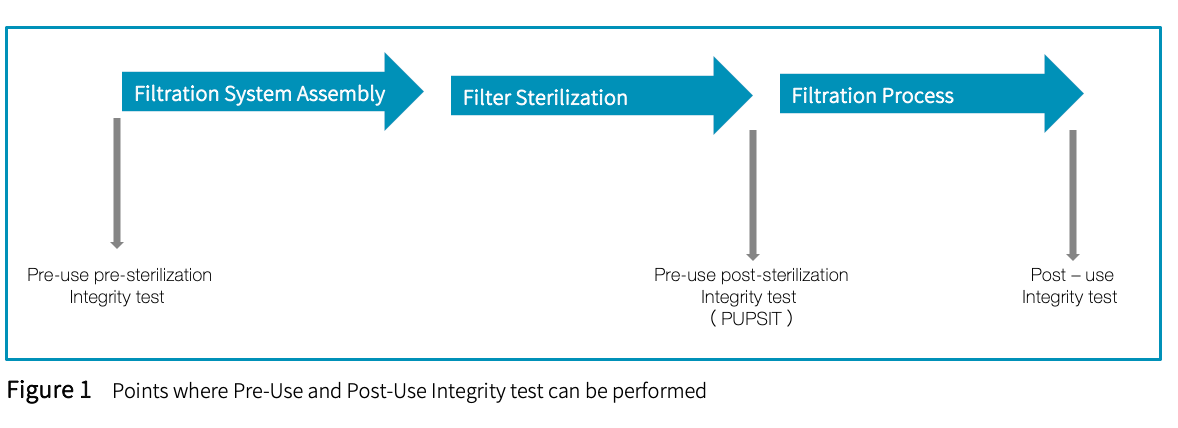
以乐纯生物集团除菌过滤工艺为例
PUPSIT 考量要点
- 操作过程对于工艺产生的额外污染风险
- 可在位/在线执行完整性测试的实现方式
- 执行的难易程度
- 系统设计是否有冗余过滤的方式
- 过滤器的润湿方式如何
- 部件是否可靠性高
- 成本因素
欧盟GMP附录1关于PUPSIT的要求
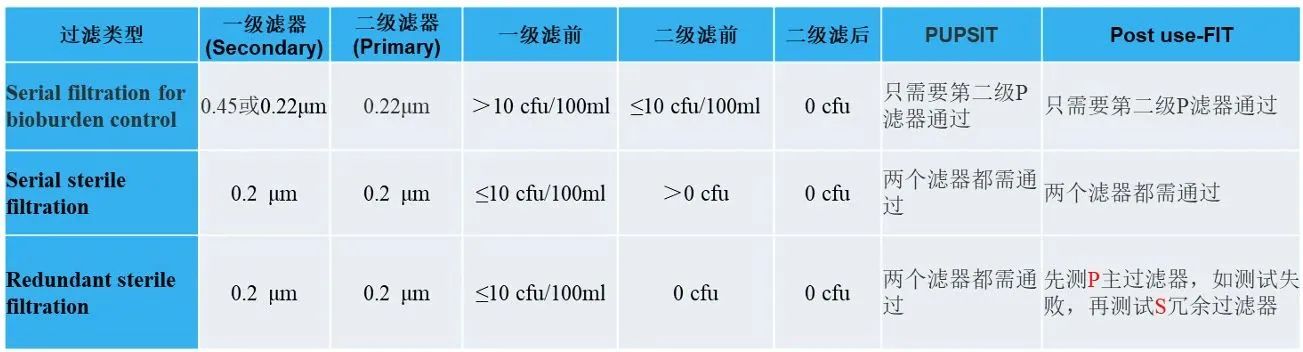
EU Annex1 PUPSIT小结
PUPSIT操作的过程中遇到的问题
问题1 :无菌润湿液操作难度大,周期长。
PUPSIT是一个技术问题,需要用户和过滤器厂家配合设计符合自身需求的系统。
问题2 :冗余设计的成本变得很大。
冗余设计为非强制性要求,需要结合自身工艺和产品质量进行。
问题3 :如果药液体积较小,担心产品被稀释时,在做完完整性测试以后,如何进行干燥的问题?
PUPSIT还是开了口子的,如果产品不能进行PUPSIT,用户需要根据CCS进行说明和制定相应的防护措施。
问题4 :EU更新了以后,WHO和PIC/S同步增加,我们自己国内要如何去面对这一条法规?
EU更新了以后,WHO和PIC/S同步增加,加之国内与WHO的接轨和正在申请加入PIC/S,需要结合产品的目标市场做好应对策略。
由于工艺限制,例如过滤非常少的溶液时,可以选择采用PUPSIT替代方法,但要进行全面的风险评估:
01.对除菌过滤工艺的深入了解与控制,以确保最大程度降低损坏过滤器的可能性
02.对供应链的深入了解和控制,包括:
- 合同灭菌措施
- 确定的运输机制
- 无菌过滤器的包装,以防止在运输和储存过程中损坏过滤器
03.对工艺的深入了解,例如:
- 具体的产品类型,包括微粒物水平以及是否存在影响过滤器完整性的任何风险,例如可能改变完整性测试值从而妨碍在使用后过滤器完整性测试中检出非完整的过滤器。
- 在最终除菌级过滤器之前的预过滤和处理步骤,这些步骤去除微粒物并使产品在除菌过滤前变澄清。
为满足最终产品质量与安全性要求,乐纯生物专为PUPSIT量身定制:
LeSiever®PES筒式 / 囊式过滤器,采用除菌级亲水性聚醚砜(PES)膜,兼具高流速和高载量的两大优点。LeSiever®PES筒式 / 囊式过滤器卓越的化学稳定性和耐高温性能,经过验证的可靠细菌截留能力,可广泛应用在细胞培养、终端制剂、原液等相关工艺的降生物负荷和除菌过滤,是生物制药领域的理想之选。

同时,我们可为您提供囊式、碟式、针头、滤芯不同类型的LeSiever®PES过滤器,多种孔径满足您不同的应用需求。
更有灌装前的双保险:PUPSIT版冗余过滤
乐纯生物根据不同地区的法规要求,设计了不同的冗余过滤系统,PUPSIT版冗余过滤采用水润湿不吹干。
这其中包括:
- 亲水滤器,用于除菌滤器的润湿
- 空气滤器,用于冗余过滤系统完整性检测
- 润洗水的接收容器
- 蝶式气体滤器,用于排除废液袋中气体
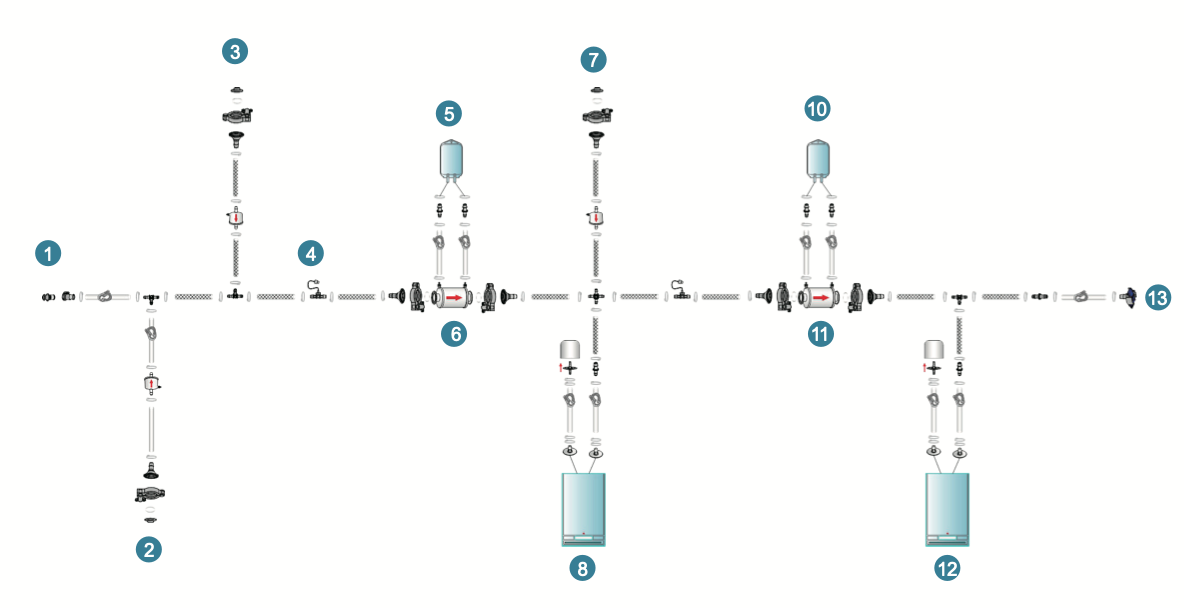
产品优势
- 灵活定制
- 供应稳定
- 超净生产平台,有效控制颗粒异物
- 100%完整性测试,ready to use
您可长按识别/扫描下方二维码,添加您的专属产品专员,针对产品进行咨询。



 EN
EN